ไฟฟ้าเคมี (ElectroChemistry)
ไฟฟ้าเคมีเป็นการศึกษาเกี่ยวกับปฏิกิริยาเคมีที่ทำให้เกิดกระแสไฟฟ้า กระแสไฟฟ้าทำให้เกิดปฏิกิริยาเคมีหากใช้การถ่ายเทอิเล็กตรอนเป็นเกณฑ์แล้วปฏิกิริยาเคมีแบ่งเป็น 2 ประเภท
1. ปฏิกิริยาที่มีการถ่ายเทe- เรียกว่าปฏิกิริยารีดอกซ์ (Redox Reaction)
2.ปฏิกิริยาที่ไม่มีการถ่ายเทe- เรียกว่าปฏิกิริยานอนรีดอกซ์ (Nonredox Reaction)
ปฏิกิริยาเคมีไฟฟ้า หรือปฏิกิริยารีดอกซ์
ปฏิกิริยารีดอกซ์ คือ ปฏิกิริยาเคมี ที่มีการแลกเปลี่ยนอิเล็กตรอนระหว่างสารตั้งต้นทำให้เลขออกซิเดชันมีการเปลี่ยนแปลงไป ซึ่งจะทำให้มีอะตอมของธาตุบางตัวสูญเสียหรือได้รับอิเล็กตรอน จะเรียกปฏิกิริยาที่เกิดการเสียอิเล็กตรอนว่า ปฏิกิริยาออกซิเดชัน (Oxidation) และเรียกปฏิกิริยาที่มีการรับอิเล็กตรอนว่า ปฏิกิริยารีดักชัน (Reduction) ดังตัวอย่าง
ปฏิกิริยาเคมีไฟฟ้า หรือปฏิกิริยารีดอกซ์สามารถนำไปใช้ประโยชน์ในชีวิตประจำวันมากมาย เช่น การชุบโลหะ การทำแบตเตอร์รี่ การแยกสารด้วยไฟฟ้า การทำสารให้บริสุทธิ์ เป็นต้น
เลขออกซิเดชัน ( Oxidation number หรือ Oxidation state )
เลขออกซิเดชัน ย่อว่า ON. คือค่าประจุไฟฟ้าที่สมมติขึ้นของไอออนหรืออะตอมของธาตุ โดยคิดจากจำนวนอิเล็กตรอนที่ให้หรือรับหรือใช้ร่วมกับอะตอมของธาตุตามเกณฑ์ที่กำหนดขึ้น
เลออกซิเดชันส่วนใหญ่เป็นเลขจำนวนเต็มบวกหรือลบหรือศูนย์ ในสารประกอบไอออนิกอะตอมมีการให้และรับอิเล็กตรอนแล้วกลายเป็นไอออนบวกและไอออนลบ ดังนั้นเลขออกซิเดชันจึงตรงกับค่าประจุไฟฟ้าที่แท้จริง ซึ่งมีค่าเท่ากับประจุไฟฟ้าของไอออนนั้นๆ ในสารประกอบโคเวเลนต์ อะตอมของธาตุใช้อิเล็กตรอนร่วมกันไม่ได้มีการให้และรับอิเล็กตรอนเหมือนกับในสารประกอบไอออนิก ดังนั้นในกรณีนี้เลขออกซิเดชันเป็นแต่เพียงประจุสมมติ ส่วนอะตอมของธาตุใดจะมีค่าเลขออกซิเดชันเป็นบวกหรือลบ ให้พิจารณา ค่าอิเล็กโทรเนกาติวิตี อะตอมของธาตุที่มีค่าอิเล็กโทรเนกาติวิตีสูงกว่าจะมีเลขออกซิเดชันเป็นลบ ส่วนอะตอมของธาตุที่มีค่าอิเล็กโทรเนกาติวิตีต่ำกว่าจะมีเลขออกซิเดชันเป็นบวก ส่วนจะมีค่าบวกเท่าไรนั้นพิจารณาได้จากจำนวนเวเลนซ์อิเล็กตรอนที่อะตอมของธาตุนำไปใช้ร่วมกับอะตอมของธาตุอื่น
หลักเกณฑ์ในการกำหนดค่าเลขออกซิเดชัน การกำหนดเลขออกซิเดชันมีเกณฑ์ดังนี้ 1. เลขออกซิเดชันของธาตุอิสระทุกชนิดไม่ว่าธาตุนั้นหนึ่งโมเลกุลจะประกอบด้วย กี่อะตอมก็ตามมีค่าเท่ากับศูนย์ เช่น Na, Zn, Cu, He, H 2, N 2, O 2, Cl 2, P 4, S 8 ฯลฯ มีเลขออกซิเดชันเท่ากับศูนย์ 2. เลขออกซิเดชันของไฮโดรเจนในสารประกอบโดยทั่วไป (H รวมตัวกับอโลหะ ) เช่น HCl , H 2O , H 2SO 4 ฯลฯ มีค่าเท่ากับ + 1 แต่ในสารประกอบไฮไดรด์ของโลหะ (H รวมตัวกับโลหะ ) เช่น NaH , CaH 2 ไฮโดรเจนมีเลขออกซิเดชันเท่ากับ -1 3. เลขออกซิเดชันของออกซิเจนในสารประกอบโดยทั่วไปเท่ากับ -2 แต่ในสารประกอบเปอร์ออกไซด์ เช่น H 2O 2 และ BaO 2 ออกซิเจนมีเลขออกซิเดชันเท่ากับ -1 ในสารประกอบซุปเปอร์ออกไซด์ ออกซิเจนมีเลขออกซิเดชันเท่ากับ -1/2 และในสารประกอบ OF 2 เท่านั้น ที่ออกซิเจนมีเลขออกซิเดชันเท่ากับ +2 4. เลขออกซิเดชันของไอออนที่ประกอบด้วยอะตอมชนิดเดียวกันมีค่าเท่ากับประจุที่แท้จริงของไอออนนั้น เช่น Mg 2+ ไอออน มีเลขออกซิเดชันเท่ากับ +2 ,F - ไอออนมีเลขออกซิเดชันเท่ากับ -1 เป็นต้น 5. ไอออนที่ประกอบด้วยอะตอมมากกว่าหนึ่งชนิด ผลรวมของเลขออกซิเดชันของอะตอมทั้งหมดจะเท่ากับประจุที่แท้จริงของไอออนนั้น เช่น SO 4 2- ไอออน เท่ากับ – 2 เลขออกซิเดชันของ NH 4 + ไอออนเท่ากับ + 1 เป็นต้น 6. ในสารประกอบใดๆ ผลบวกของเลขออกซิเดชันของอะตอมทั้งหมดเท่ากับศูนย์ เช่น H 2O H มีเลขออกซิเดชันเท่ากับ + 1 แต่มี H 2 อะตอม จึงมีเลขออกซิเดชันทั้งหมด เท่ากับ + 2 O มีเลขออกซิเดชันเท่ากับ – 2 เมื่อรวมกันจะเท่ากับศูนย์เป็นต้น
เลขออกซิเดชัน ย่อว่า ON. คือค่าประจุไฟฟ้าที่สมมติขึ้นของไอออนหรืออะตอมของธาตุ โดยคิดจากจำนวนอิเล็กตรอนที่ให้หรือรับหรือใช้ร่วมกับอะตอมของธาตุตามเกณฑ์ที่กำหนดขึ้น
เลออกซิเดชันส่วนใหญ่เป็นเลขจำนวนเต็มบวกหรือลบหรือศูนย์ ในสารประกอบไอออนิกอะตอมมีการให้และรับอิเล็กตรอนแล้วกลายเป็นไอออนบวกและไอออนลบ ดังนั้นเลขออกซิเดชันจึงตรงกับค่าประจุไฟฟ้าที่แท้จริง ซึ่งมีค่าเท่ากับประจุไฟฟ้าของไอออนนั้นๆ ในสารประกอบโคเวเลนต์ อะตอมของธาตุใช้อิเล็กตรอนร่วมกันไม่ได้มีการให้และรับอิเล็กตรอนเหมือนกับในสารประกอบไอออนิก ดังนั้นในกรณีนี้เลขออกซิเดชันเป็นแต่เพียงประจุสมมติ ส่วนอะตอมของธาตุใดจะมีค่าเลขออกซิเดชันเป็นบวกหรือลบ ให้พิจารณา ค่าอิเล็กโทรเนกาติวิตี อะตอมของธาตุที่มีค่าอิเล็กโทรเนกาติวิตีสูงกว่าจะมีเลขออกซิเดชันเป็นลบ ส่วนอะตอมของธาตุที่มีค่าอิเล็กโทรเนกาติวิตีต่ำกว่าจะมีเลขออกซิเดชันเป็นบวก ส่วนจะมีค่าบวกเท่าไรนั้นพิจารณาได้จากจำนวนเวเลนซ์อิเล็กตรอนที่อะตอมของธาตุนำไปใช้ร่วมกับอะตอมของธาตุอื่น
หลักเกณฑ์ในการกำหนดค่าเลขออกซิเดชัน การกำหนดเลขออกซิเดชันมีเกณฑ์ดังนี้ 1. เลขออกซิเดชันของธาตุอิสระทุกชนิดไม่ว่าธาตุนั้นหนึ่งโมเลกุลจะประกอบด้วย กี่อะตอมก็ตามมีค่าเท่ากับศูนย์ เช่น Na, Zn, Cu, He, H 2, N 2, O 2, Cl 2, P 4, S 8 ฯลฯ มีเลขออกซิเดชันเท่ากับศูนย์ 2. เลขออกซิเดชันของไฮโดรเจนในสารประกอบโดยทั่วไป (H รวมตัวกับอโลหะ ) เช่น HCl , H 2O , H 2SO 4 ฯลฯ มีค่าเท่ากับ + 1 แต่ในสารประกอบไฮไดรด์ของโลหะ (H รวมตัวกับโลหะ ) เช่น NaH , CaH 2 ไฮโดรเจนมีเลขออกซิเดชันเท่ากับ -1 3. เลขออกซิเดชันของออกซิเจนในสารประกอบโดยทั่วไปเท่ากับ -2 แต่ในสารประกอบเปอร์ออกไซด์ เช่น H 2O 2 และ BaO 2 ออกซิเจนมีเลขออกซิเดชันเท่ากับ -1 ในสารประกอบซุปเปอร์ออกไซด์ ออกซิเจนมีเลขออกซิเดชันเท่ากับ -1/2 และในสารประกอบ OF 2 เท่านั้น ที่ออกซิเจนมีเลขออกซิเดชันเท่ากับ +2 4. เลขออกซิเดชันของไอออนที่ประกอบด้วยอะตอมชนิดเดียวกันมีค่าเท่ากับประจุที่แท้จริงของไอออนนั้น เช่น Mg 2+ ไอออน มีเลขออกซิเดชันเท่ากับ +2 ,F - ไอออนมีเลขออกซิเดชันเท่ากับ -1 เป็นต้น 5. ไอออนที่ประกอบด้วยอะตอมมากกว่าหนึ่งชนิด ผลรวมของเลขออกซิเดชันของอะตอมทั้งหมดจะเท่ากับประจุที่แท้จริงของไอออนนั้น เช่น SO 4 2- ไอออน เท่ากับ – 2 เลขออกซิเดชันของ NH 4 + ไอออนเท่ากับ + 1 เป็นต้น 6. ในสารประกอบใดๆ ผลบวกของเลขออกซิเดชันของอะตอมทั้งหมดเท่ากับศูนย์ เช่น H 2O H มีเลขออกซิเดชันเท่ากับ + 1 แต่มี H 2 อะตอม จึงมีเลขออกซิเดชันทั้งหมด เท่ากับ + 2 O มีเลขออกซิเดชันเท่ากับ – 2 เมื่อรวมกันจะเท่ากับศูนย์เป็นต้น
เซลล์กัลวานิก
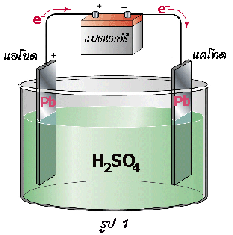
ปฏิกิริยารีดอกซ์ที่เกิดขึ้นเมื่อนำแผ่นสังกะสีจุ่มลงในสารละลายของทองแดง หรือตัวรีดิวซ์จุ่มลงในตัวออกซิไดซ์โดยตรงแล้วในบทนำ ปฏิกิริยาที่เกิดขึ้นทำให้เกิดพลังงานในรูปของความร้อน แต่ถ้าแยกตัวรีดิวซ์ออกจากตัวออกซิไดซ์ แล้วเชื่อมต่อวงจรภายนอกและสะพานเกลือ ( salt bridge) อิเล็กตรอนก็จะถูกถ่ายโอนผ่านตัวกลางภายนอกจากขั้วไฟฟ้าที่เกิดปฏิกิริยาออกซิเดชันไปยังขั้วไฟฟ้าที่เกิดปฏิกิริยารีดักชัน จึงทำให้เกิดกระแสไฟฟ้าได้ เซลล์ไฟฟ้าที่เกิดจากปฏิกิริยาเคมีนี้เรียกว่า เซลล์กัลวานิก หรือเซลล์โวลตาอิก (galvanic cell or voltaic cell) ดังภาพ
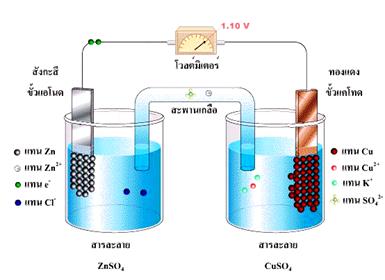
จากรูปเซลล์กัลวานิกประกอบด้วยสองครึ่งเซลล์ โดยแต่ละครึ่งเซลล์จะประกอบด้วยขั้วไฟฟ้าที่จุ่มลงในสารละลาย แท่งสังกะสีและแท่งทองแดงในเซลล์เป็นขั้วไฟฟ้าซึ่งเรียกว่า อิเล็กโทรด ( electrode ) ขั้วที่เกิดปฏิกิริยาออกซิเดชัน เรียกว่า ขั้วแอโนด ( anode ) และขั้วที่เกิดปฏิกิริยารีดักชัน เรียกว่า ขั้วแคโทด (cathode)
ปฏิกิริยาออกซิเดชันที่แอโนด ( Zn ) Zn (s )  Zn 2+(aq) + 2e -
Zn 2+(aq) + 2e -
ปฏิกิริยารีดักชันที่แคโทด (Cu ) Cu 2+(aq) + 2e - Cu(s)
Cu(s)
เซลล์กัลวานิกแบ่งออกได้เป็น 2 ชนิด
1. เซลล์ปฐมภูมิ (Primary cell) เมื่อปฏิกิริยาเคมีภายในเซลล์เกิดขึ้นและดำเนินไปแล้ว ปฏิกิริยาจะเกิดขึ้นอย่างสมบูรณ์และเกิดปฏิกิริยาย้อนกลับไม่ได้หรือนำมาอัดไฟใหม่ไม่ได้
2 เซลล์ทุติยภูมิ (Secondary cell) เกิดปฏิกิริยาย้อนกลับได้หรือนำมาอัดไฟใหม่ได้
ศักย์ไฟฟ้าอิเล็กโทดมาตรฐาน
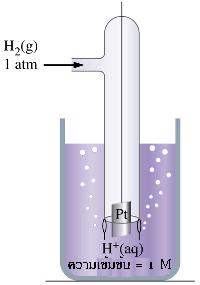
จากเซลล์ไฟฟ้า Zn -Cu เมื่อใช้ความเข้มข้นของไอออนของสารละลายในแต่ละครึ่งเซลล์เท่ากับ 1.0 M ที่ 25 ๐C เซลล์ไฟฟ้านี้จะมี emf เท่ากับ 1.10 V ถ้าทราบศักย์ไฟฟ้าของอิเล็กโทรดใดอิเล็กโทรดหนึ่งแล้วนำไปลบออกจาก 1.10 V ก็จะทราบค่าของอิเล็กโทรดหนึ่ง แต่ในทางปฏิบัติไม่สามารถวัดศักย์ไฟฟ้าของอิเล็กโทรดเดี่ยว ๆ ได้ จึงได้มีการกำหนดอิเล็กโทรดมาตรฐานขึ้นมา ซึ่งได้แก่ ไฮโดรเจนอิเล็กโทรดมาตรฐาน (Standard Hydrogen Electrode : SHE) ในครึ่งเซลล์ไฮโดรเจนมาตรฐานนี้ประกอบด้วย ขั้วแพลตินัม (อิเล็กโทรดเฉื่อย) สารละลายกรดไฮโดรคลอริก และก๊าซไฮโดรเจนภายใต้ สภาวะมาตรฐาน ( ความดันของก๊าซไฮโดรเจนเท่ากับ 1 atm ความเข้มข้นของสารละลายกรดไฮโดรคลอริกเท่ากับ 1 M และวัดที่อุณหภูมิ 25 ๐C) โดยผ่านก๊าซไฮโดรเจนในสารละลายกรดไฮโดรคลอริกตลอดเวลา จึงมีสมดุลเกิดขึ้นดังสมการ
2H +(aq) + 2e - H 2(g)
H 2(g)
ค่าศักย์มาตรฐานของครึ่งเซลล์ไฮโดรเจนมาตรฐานเท่ากับ 0.00 V ใช้สัญลักษณ์ E ๐ แทนศักย์ไฟฟ้า
ที่สภาวะมาตรฐาน
ที่สภาวะมาตรฐาน
หมายเหตุ : ครึ่งเซลล์เป็นเหมือนอิเล็กโทรดหรือขั้ว
สามารถใช้ครึ่งเซลล์ไฮโดรเจนมาตรฐานนี้ในการหาศักย์ไฟฟ้าของอิเล็กโทรดอื่น เช่น เมื่อต่อเซลล์กัลวานิก ระหว่างครึ่งเซลล์ SHE และครึ่งเซลล์ Cu ดังรูป
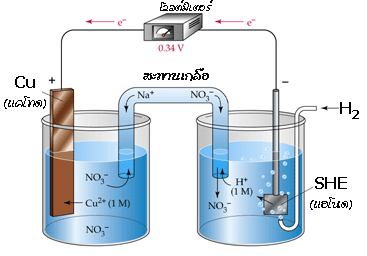
จากโวลต์มิเตอร์ได้ค่าศักย์ไฟฟ้ามาตรฐานของเซลล์เท่ากับ 0.34 V โดยมีปฏิกิริยาเกิดขึ้นดังนี้
ปฏิกิริยาออกซิเดชันที่แอโนด (SHE ) H 2(g) -----------> 2H +(aq) + 2e -
ปฏิกิริยารีดักชันที่แคโทด (Cu ) Cu 2+(aq) + 2e - -----------> Cu(s)
จาก E ๐ cell = E ๐ cathode - E ๐ anode
ดังนั้น E ๐ cell = E ๐ Cu - E ๐ SHE
0.34 V = E ๐ Cu - 0.00 V
E ๐ Cu = 0.34 V - 0.00 V = 0.34 V
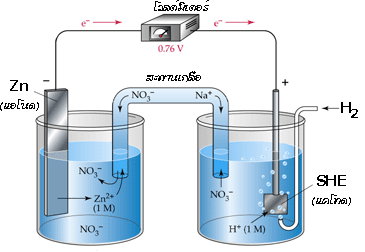
เมื่อต่อเซลล์กัลวานิกระหว่างครึ่งเซลล์ SHE และครึ่งเซลล์ Zn จะได้เป็น
อ่านค่าศักย์ไฟฟ้ามาตรฐานของเซลล์ได้เท่ากับ 0.76 V โดยมีปฏิกิริยาเกิดขึ้น ดังสมการ
ปฏิกิริยาออกซิเดชันที่แอโนด (Zn ) Zn (s )  Zn 2+(aq) + 2e -
Zn 2+(aq) + 2e -
ปฏิกิริยารีดักชันที่แคโทด (SHE ) 2H +(aq) + 2e - H 2(g)
H 2(g)
จาก E ๐ cell = E ๐ cathode - E ๐ anode
ดังนั้น E ๐ cell = E ๐ SHE - E ๐ Zn
จาก E ๐ cell = E ๐ cathode - E ๐ anode
ดังนั้น E ๐ cell = E ๐ SHE - E ๐ Zn
0.76 V = 0.00 V - E ๐ Zn
E ๐ Zn = 0.00 V – 0.76 V = -0.76 V
ค่า E ๐ ที่ได้เป็นค่าศักย์รีดักชันของแต่ละครึ่งเซลล์ นั่นคือ
Cu 2+(aq) + 2e - Cu(s) E ๐ = +0.34 V
Cu(s) E ๐ = +0.34 V
Zn 2+(aq) + 2e - Zn(s) E ๐ = -0.76 V
Zn(s) E ๐ = -0.76 V
การเขียนแผนภาพของเซลล์กัลวานิกมีหลักดังนี้
1. เขียนครึ่งเซลล์ที่เกิดปฏิกิริยาออกซิเดชันไว้ทางซ้ายมือ โดยเขียนขั้วไฟฟ้าไว้ทางซ้ายสุด ตามด้วยไอออนในสารละลาย และใช้เส้นเดี่ยว / ขีดคั่นระหว่างขั้วไฟฟ้ากับไอออนในสารละลาย เช่น Zn(s)/Zn 2+(aq)
2. เขียนครึ่งเซลล์เซลล์ที่เกิดปฏิกิริยารีดักชันไว้ทางขวามือ โดยเขียนไอออนในสารละลายก่อน ตามด้วยขั้วไฟฟ้าไว้ทางขวาสุด และใช้เส้นเดี่ยว / ขีดคั่นระหว่างขั้วไฟฟ้ากับไอออนในสารละลาย เช่น Cu 2+(aq)/Cu(s)
3. สำหรับครึ่งเซลล์ที่ประกอบด้วยโลหะกับก๊าซ ใช้เส้นเดี่ยว / ขีดคั่นระหว่างขั้วไฟฟ้ากับก๊าซและระหว่างไอออนในสารละลาย เช่น Pt(s)/H 2(g,1 atm)/H +(aq)
4. เขียนเส้นคู่ขนาน // แทนสะพานไอออนกั้นระหว่างครึ่งเซลล์ทั้งสอง เช่น
Zn(s)/Zn 2+(aq)// Cu 2+(aq)/Cu(s)
Pt(s)/H 2(g,1 atm)/H +(1 mol/dm 3)// Cu 2+(1 mol/dm 3)/Cu(s)
5. สำหรับครึ่งเซลล์ที่มีสารสถานะเดียวกันมากกว่าหนึ่งชนิด ให้ใช้เครื่องหมายจุลภาคคั่นระหว่างไอออนทั้งสอง เช่น
Fe(s)/Fe 2+(aq),Fe 3+(aq)// Cu 2+(aq)/Cu(s)
เซลล์ปฐมภูมิมีหลายชนิด
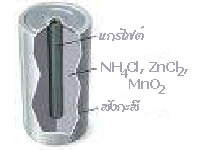
1. เซลล์แห้ง (Dry Cell ) หรือเซลล์เลอคลังเช (LeClanche Cell)
เซลล์ไฟฟ้าชนิดนี้ถูกเรียกว่า เซลล์แห้ง เพราะไม่ได้ใช้ของเหลวเป็นอิเล็กโทรไลต์ เป็นเซลล์ที่ใช้ในไฟฉาย หรือใช้ในประโยชน์อื่น ๆ เช่น ในวิทยุ เครื่องคิดเลข ฯลฯ ซึ่งมีลักษณะตามรูป
2. เซลล์แอลคาไลน์ (Alkaline Cell )
เซลล์แอลคาไลน์มีส่วนประกอบของเซลล์เหมือนกับเซลล์เลอคลังเช แต่มีสิ่งที่แตกต่างกันคือเซลล์แอลคาไลน์ใช้ เบสซึ่งได้แก่โพแตสเซียมไฮดรอกไซด์ (KOH ) เป็นอิเล็กโทรไลต์แทนแอมโมเนียมคลอไรด์ (NH 4Cl) และเนื่องจากใช้สารละลายเบสนี่เองเซลล์ชนิดนี้จึงถูกเรียกว่า เซลล์แอลคาไลน์
ที่ขั้วแอโนด (Zn -ขั้วลบ) Zn ถูกออกซิไดซ์
Zn(s) + 2OH -(aq)  ZnO(s) + H 2O(l) + 2e -
ZnO(s) + H 2O(l) + 2e -
ที่ขั้วแคโทด (C -ขั้วบวก) MnO 2 จะถูกรีดิวซ์ ไปเป็น Mn 2O 3
2MnO 2(s) + H 2O(l) + 2e - Mn 2O 3(s) + 2OH -(aq)
Mn 2O 3(s) + 2OH -(aq)
สมการรวม Zn (s ) + 2MnO 2(s)  ZnO(s) + Mn 2O 3(s)
ZnO(s) + Mn 2O 3(s)
เซลล์นี้จะให้ศักย์ไฟฟ้าประมาณ 1.5 โวลต์ แต่ให้กระแสไฟฟ้าได้มากกว่าและนานกว่าเซลล์แห้ง เพราะ OH - ที่เกิดขึ้นที่ขั้วคาร์บอนสามารถนำกลับไปใช้ที่ขั้วสังกะสีได้
3. เซลล์ปรอท (Mercury Cell )
มีหลักการเช่นเดียวกับเซลล์แอลคาไลน์ แต่ใช้เมอร์คิวรี (II ) ออกไซด์ (HgO ) แทนแมงกานีส (IV ) ออกไซด์ (MnO 2) เป็นเซลล์ที่มีขนาดเล็กใช้กันมากในเครื่องฟังเสียงสำหรับคนหูพิการ หรือใช้ในอุปกรณ์อื่น เช่น นาฬิกาข้อมือ เครื่องคิดเลข เซลล์นี้จะให้ศักย์ไฟฟ้าประมาณ 1.3 โวลต์ ให้กระแสไฟฟ้าต่ำ แต่สามารถให้ค่าศักย์ไฟฟ้าคงที่ตลอดอายุการใช้งาน มีปฏิกิริยาเคมีดังนี้
ที่ขั้วแอโนด Zn (s ) + 2OH -(aq)  ZnO(s) + H 2O(l) + 2e -
ZnO(s) + H 2O(l) + 2e -
ที่ขั้วแคโทด HgO (s ) + H 2O(l) + 2e - Hg(l) + 2OH -(aq)
Hg(l) + 2OH -(aq)
ปฏิกิริยารวม Zn (s ) + HgO (s )  ZnO(s) + Hg(l)
ZnO(s) + Hg(l)
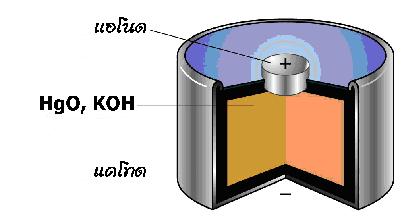
ส่วนประกอบของเซลล์ปรอท
เซลล์ทุติยภูมิมีหลายชนิด
1. แบตเตอรี่สะสมไฟฟ้าแบบตะกั่ว ( Lead Storage Battery)
แบตเตอรี่คือเซลล์ไฟฟ้าหลาย ๆ เซลล์ต่อกันเป็นอนุกรม แบตเตอรี่สะสมไฟฟ้าแบบตะกั่วนี้เป็นแบตเตอรีที่ใช้ในรถยนต์ โดยประกอบด้วยเซลล์ไฟฟ้า 6 เซลล์ แต่ละเซลล์จะมีศักย์ไฟฟ้า 2 โวลต์ ดังนั้นแบตเตอรี่ในรถยนต์มีศักย์ไฟฟ้า 12 โวลต์
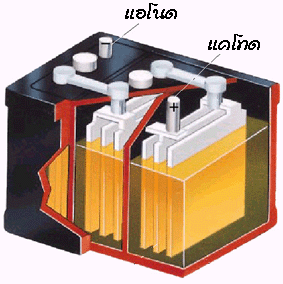
ส่วนประกอบของแบตเตอรี่สะสมไฟฟ้าแบบตะกั่ว
เซลล์สะสมไฟฟ้าแบบตะกั่ว
1) เมื่ออัดไฟครั้งแรก 2) เมื่อจ่ายไฟ 3) เมื่ออัดไฟครั้งต่อไป
1) เมื่ออัดไฟครั้งแรก 2) เมื่อจ่ายไฟ 3) เมื่ออัดไฟครั้งต่อไป
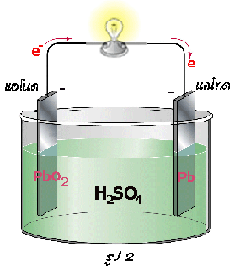
แบตเตอรี่สะสมไฟฟ้าแบบตะกั่วจะประกอบด้วยอิเล็กโทรดคือแผ่นตะกั่ว มีกรดซัลฟิวริกเจือจางเป็นอิเล็กโทรไลต์ เมื่อมีการอัดไฟครั้งแรกแผ่นตะกั่วที่ต่อกับขั้วบวกของแบตเตอรี (ขั้วแอโนด) จะถูกออกซิไดซ์เป็นเลด (II ) ไอออน ดังสมการ
Pb(s)  Pb 2+(aq) + 2e -
Pb 2+(aq) + 2e -
เมื่อรวมกับออกซิเจนที่เกิดขึ้นจะกลายเป็นเลด (IV ) ออกไซด์
Pb 2+(aq) + O 2(g)  PbO 2(s)
PbO 2(s)
ดังนั้นที่ขั้วแอโนด (ขั้วบวก) แผ่นตะกั่วจะถูกเปลี่ยนเป็นเลด (IV ) ออกไซด์ขั้วไฟฟ้าจึงแตกต่างกัน (ขั้วแอโนด-ขั้วบวก: PbO 2 และขั้วแคโทด-ขั้วลบ: Pb) ทำให้สามารถเกิดกระแสไฟฟ้าได้หรือจ่ายไฟได้นั่นเอง
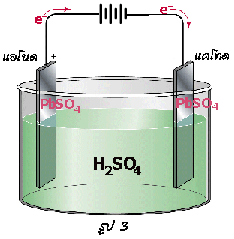
การจ่ายไฟเกิดขึ้น ดังสมการ
การจ่ายไฟเกิดขึ้น ดังสมการ
ขั้วแอโนด-ขั้วลบ: Pb (s ) + SO 4 2-(aq)  PbSO 4(s) + 2e -
PbSO 4(s) + 2e -
ขั้วแคโทด-ขั้วบวก: PbO 2(s) + SO 4 2-(aq) + 4H +(aq) + 2e - PbSO 4(s) + 2H 2O(l)
PbSO 4(s) + 2H 2O(l)
อิเล็กตรอนจะเคลื่อนที่จากขั้วแอโนดหรือขั้วลบผ่านวงจรภายนอกไปยังขั้วแคโทดหรือขั้วบวก จากสมการจะสังเกตได้ว่ามีผลิตภัณฑ์คือ PbSO 4(s) เกิดขึ้นเหมือนกัน ดังนั้นเมื่อใช้แบตเตอรี่ไประยะหนึ่งความต่างศักย์จะลดลง และจะลดลงไปเรื่อย ๆ จนกระทั่งเป็นศูนย์ ทั้งนี้เนื่องจากขั้วไฟฟ้าทั้งคู่เหมือนกัน จึงไม่มีความแตกต่างของศักย์ไฟฟ้าระหว่างขั้วทั้งสอง
ปฏิกิริยาของเชลล์ข้างบนเป็นผันกลับได้ ดังนั้นถ้าต้องการให้เกิดการผันกลับจึงจำเป็นต้องมีการอัดไฟฟ้าใหม่ โดยการต่อขั้วบวกของเซลล์กับขั้วบวกของแบตเตอรี่และขั้วลบกับขั้วลบของแบตเตอรี่ ปฏิกิริยาข้างบนก็จะเปลี่ยนทิศทางเป็นจากขวาไปซ้าย ในลักษณะนี้เลด(II ) ซัลเฟตที่ขั้วลบก็จะเปลี่ยนเป็นตะกั่ว ส่วนอีกขั้วหนึ่ง เลด (II ) ซัลเฟตจะเปลี่ยนเป็นเลด (IV ) ออกไซด์ ดังสมการ
ขั้วแอโนด-ขั้วบวก: PbSO 4(s) + 2H 2O(l) PbO 2(s) + SO 4 2-(aq) + 4H +(aq) + 2e -
PbO 2(s) + SO 4 2-(aq) + 4H +(aq) + 2e -
ขั้วแคโทด-ขั้วลบ: PbSO 4(s) + 2e - Pb(s) + SO 4 2-(aq)
Pb(s) + SO 4 2-(aq)
จากปฏิกิริยาในขณะที่มีการจ่ายไฟฟ้า ความเข้มข้นของกรดจะลดลงเรื่อย ๆ จากปกติที่มีความถ่วงจำเพาะ ประมาณ 1.25 ถึง 1.30 แล้วแต่อุณหภูมิในขณะนั้น ๆ ถ้าหากเมื่อใดมีความถ่วงจำเพาะต่ำกว่า 1.20 ที่อุณหภูมิของห้องก็ควรจะมีการอัดไฟฟ้าใหม่ได้
2. ซลล์นิกเกิล-แคดเมียม หรือเซลล์นิแคด (Nickel-Cadmium Cell)

ที่ขั้วแอโนด: Cd(s) + 2OH -(aq)  Cd(OH) 2(s) + 2e -
Cd(OH) 2(s) + 2e -
ที่ขั้วแคโทด: NiO 2(s) + 2H 2O(l) + 2e - Ni(OH) 2(s) + 2OH -(aq)
Ni(OH) 2(s) + 2OH -(aq)
ปฏิกิริยารวม: Cd(s) + NiO 2(s) + 2H 2O(l)  Cd(OH) 2(s) + Ni(OH) 2(s)
Cd(OH) 2(s) + Ni(OH) 2(s)
3. เซลล์ลิเทียมไอออน ( Lithium Ion Cell)
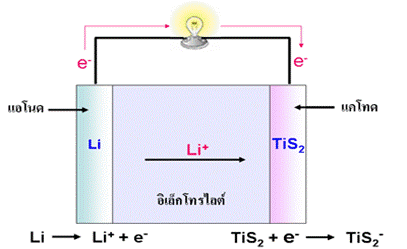

เซลล์ลิเทียมอาจให้ศักย์ไฟฟ้าสูงถึง 3 โวลต์ เป็นเซลล์ที่ใช้อิเล็กโทรไลต์เป็นของแข็งได้แก่สารพอลิเมอร์ที่ยอมให้ไอออนผ่านแต่ไม่ยอมให้อิเล็กตรอนผ่าน ขั้วแอโนดคือลิเทียมซึ่งเป็นธาตุที่มีค่าศักย์ไฟฟ้ารีดักชันมาตรฐานต่ำที่สุด มีความสามารถในการให้อิเล็กตรอนได้ดีที่สุด ส่วนแคโทดใช้สารที่เรียกว่าสารประกอบแทรกชั้น (Insertion Compound ) ได้แก่ TiS 2 หรือ V 6O 13
เซลล์อิเล็กโทรไลต์
เมื่อผ่านไฟฟ้าเข้าไปในเซลล์ที่ประกอบด้วยขั้วไฟฟ้าสองขั้วจุ่มอยู่ในสารละลายอิเล็กโทรไลต์ จะเกิดปฏิกิริยาเกิดขึ้นภายในเซลล์ เรียกกระบวนการนี้ว่า อิเล็กโทรลิซิส ( electrolysis ) และเรียกเซลล์ไฟฟ้าเคมีนี้ว่า เซลล์อิเล็กโทรไลต ์ ดังรูป
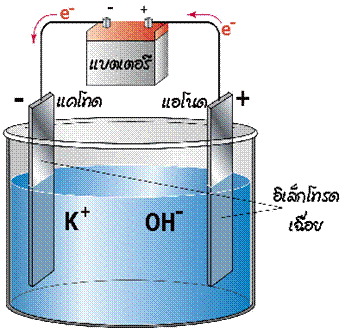
ในการพิจารณาขั้วบวก/ขั้วลบจะพิจารณาจากปริมาณอิเล็กตรอนว่ามีมากหรือน้อย
- เซลล์แกลแวนิก ขั้วที่เกิดออกซิเดชันมีอิเล็กตรอนสะสม(จากภายใน) จึงเป็นขั้วลบ
- เซลล์แกลแวนิก ขั้วที่เกิดรีดักชันมีอิเล็กตรอนสะสม(จากภายนอก) จึงเป็นขั้วลบ
ในเมื่อแบตเตอรี่เป็นตัวจ่ายกระแสไฟฟ้า อิเล็กตรอนจะเคลื่อนที่ออกจากขั้วแอโนด (ขั้วลบ) ของแบตเตอรี่ผ่านลวดตัวนำไปยังขั้วไฟฟ้าของเซลล์อิเล็กโทรไลต์ ดังนั้นขั้วไฟฟ้าที่ต่อกับขั้วลบของแบตเตอรี่จะเป็นขั้วแคโทด เพราะเป็นขั้วที่เกิดปฏิกิริยารีดักชัน และเนื่องจากต่อกับขั้วลบ ขั้วไฟฟ้านี้จึงเป็นขั้วลบ ส่วนขั้วไฟฟ้าอีกขั้วหนึ่งเกิดปฏิกิริยาออกซิเดชันจึงเป็นขั้วแอโนด และต่อกับขั้วบวกของแบตเตอรี่จึงเป็นขั้วบวก อิเล็กตรอนเคลื่อนที่ออกจากขั้วแอโนดของเซลล์เข้าสู่แบตเตอรี่
สามารถศึกษาเพิ่มเติมได้ที่ http://www.nakhamwit.ac.th/pingpong_web/Elec_Chem.htm

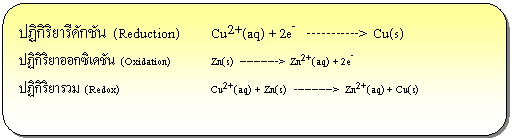
เนื้อหาอ่านเข้าใจง่ายดีจ้า
ตอบลบดูภาพรวมแล้วได้มีกานใช้ภาพประกอบการบรรยายได้คล้อยตามเนื้อหาที่อธิบายไว้ เนื้อหามีความกระทัดรัด เข้าใจง่ายมากคะ
ตอบลบสวยคะ
ตอบลบเนื้อหามีประโยชน์และความรู้มากคะ องค์ประกอบสวยงาม
ตอบลบอ่านเเล้วทำคะเเนนสอบได้เกือบเต็มเลยค่ะ
ตอบลบเนื้อหาสาระดีมากครับ สามารถใช้เป็นสื่อการเรียนการสอนได้
ตอบลบเนื้อหาเข้าใจง่ายมาก ทำข้อสอบได้เกือบทุกข้อเลยจ้า
ตอบลบเนื้อหาดี อธิบายเข้าใจมากค่ะ
ตอบลบอ่านแล้ว ได้ความรู้เพิ่มเติมมากเนื้อหาดีเข้าใจง่ายครับ
ตอบลบสวยงามและน่าอ่านครับ
ตอบลบสวยมากจากเนื้อหาน่าสนใจมาก
ตอบลบน่าอ่านมากค่ะ สีสันสวยงาม
ตอบลบอ่านแล้วได้ความรู้เพิ่มขึ้นค่ะ
ตอบลบเนื้อหาอ่านแล้วเข้าใจง่าย อธิบายละเอียด
ตอบลบ